QUÍMICA
Métodos de separación de fases
*Los métodos de separación de fases de mezclas son
aquellos procesos físicos por los cuales se pueden separar los componentes de
una mezcla.
*La separación es la operación en la que una mezcla se
somete a algún tratamiento que la divide en al menos dos sustancias diferentes.
En el proceso de separación, las sustancias conservan su identidad, sin cambio
alguno en sus propiedades químicas.
Los métodos de separación de mezclas
más comunes son los siguientes:
Decantación: La decantación se utiliza
para separar líquidos que no se disuelven entre sí (como agua y aceite) o un
sólido insoluble en un líquido (como agua y arena). El aparato utilizado
se llama ampolla o embudo de decantación.
Filtración: Separación de sólidos en
suspensión en un líquido mediante un medio poroso, que retiene los sólidos y
permite el pasaje del líquido
La filtración es el método que se usa
para separar un sólido insoluble de un líquido. El sólido queda retenido en un medio poroso o filtro por el cual se
hace pasar la mezcla. Ejemplos de filtros los coladores para hacer café,
telas de algodón o sintéticas, coladores o cribas caseros y los filtros porosos
industriales, de cerámica, vidrio, arena o carbón.
Tamización: La tamización o tamizado es
un método físico para separar mezclas en el cual se separan dos sólidos
formados por partículas de tamaño diferente.
Consiste en hacer pasar una mezcla de
partículas de diferentes tamaños por un tamiz, cedazo o cualquier cosa con la
que se pueda colar. Las partículas de menor tamaño pasan por los poros del
tamiz o colador atravesándolo y las grandes quedan atrapadas por el mismo.
Tría: Es un método de separación que consiste en separar con pinzas o
simplemente con las manos las fases sólidas de mayor tamaño de las de menor
tamaño dispersas en otro sólido o en un líquido de un sistema heterogéneo. Es
un tipo de tamización.
Flotación: La flotación es en realidad una forma de decantación.
Se utiliza para separar un sólido con menos densidad que el líquido en que está
suspendido, por ejemplo, en una mezcla de agua y pedazos de corcho.
Cristalización:
- Es un proceso por el cual a partir de
un gas, un líquido o una disolución, los iones, átomos o moléculas establecen
enlaces hasta formar una red cristalina, la unidad básica de un cristal.
-La cristalización se emplea con
bastante frecuencia en Química para purificar una sustancia sólida.
-La operación de cristalización es el
proceso por medio del cual se separa un componente de una solución líquida
transfiriéndolo a la fase sólida en forma de cristales que precipitan. Un sistema material homogéneo por ejemplo: el agua
potable es una solución formada por agua y sales disueltas en ella. Los tres
métodos más conocidos son: Evaporación o capitalización, cromatografía y
destilación.
Imantación: Es un método que consiste en
separar una mezcla en la que una de las sustancias tiene propiedades magnéticas
,es decir, se utiliza un material que contenga un campo magnético para separar
las sustancias metálicas en la mezcla, como la extracción de las limaduras de
hierro en una mezcla con arena.

Destilación: La destilación se usa para separar dos líquidos
miscibles entre sí, que tienen distinto punto de ebullición, como una mezcla de
agua y alcohol etílico; o bien, un sólido no volátil disuelto en un líquido,
como la mezcla de permanganato de potasio disuelto en agua. El proceso de
destilación se inicia al someter a altas temperaturas la mezcla. El líquido más
volátil se evaporará primero, quedando el otro puro. Luego, la fase evaporada
se recupera mediante condensación al disminuir la temperatura. Se contemplan
dos tipos de destilación: la destilación simple en la cual se separan sólido y
líquido; y la destilación fraccionada en la que se separan dos líquidos. En la
segunda es en la que se obtiene una mejor separación de los componentes, si
bien esta va a depender de qué tan alta sea la diferencia entre los puntos de
ebullición de las diferentes fases.

La levigación: es un método que consiste
en tratar una mezcla con un disolvente líquido para separar algunos de sus
componentes, ya sea por el arrastre de una sustancia, como en la extracción del
almidón, o porque una fase es soluble en el líquido y por ende se separa del
resto de la mezcla, no soluble. Es una mezcla de dos elementos o más.
Levigación o lixiviación selectiva: Este método de separación consiste en extraer, por
medio de disolventes orgánicos, aceites esenciales de plantas aromáticas o
medicinales. La lixiviación es común en la confección de perfumes, productos de
limpieza y medicamentos. De igual manera, se utiliza en la extracción de
minerales en las minas como las esmeraldas, joyas, diamantes, oro,etc.
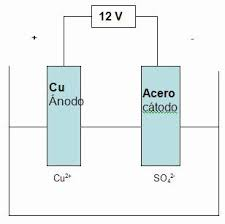
Electrolisis: es el proceso que separa
los elementos de un compuesto por medio de la electricidad. En ella ocurre la
captura de electrones por los cationes en el cátodo (una reducción) y la
liberación de electrones por los aniones en el ánodo (una oxidación).
Centrifugación: Es un método por el cual se pueden
separar sólidos de líquidos de diferente densidad mediante una fuerza
giratoria. La fuerza centrífuga es provista por una máquina llamada centrifugadora,
la cual imprime a la mezcla un movimiento de rotación que origina una fuerza
que produce la sedimentación de los sólidos o de las partículas de mayor
densidad. Los componentes más densos de
la mezcla se desplazan fuera del eje de rotación de la centrífuga, mientras que
los componentes menos densos de la mezcla se desplazan hacia el eje de
rotación. De esta manera los químicos y biólogos pueden aumentar la fuerza de
gravedad efectiva en un tubo de ensayo para producir una precipitación del sedimento
en la base del tubo de ensayo de manera más rápida y completa.
Cromatografía:
Es escribir en colores por un proceso físico de
separación de separación de substancias llevado a cabo por la distribución en
dos fases. Fase móvil (gas-líquido) y Fase estacionaria (sólido-líquido). Dependiendo del estado de
las fases involucradas es posible desarrollar varios tipos de cromatografía,
cuando la fase móvil es un gas se denomina Cromatografía de Gases y cuando la
fase móvil es un líquido se denomina Cromatografía de Líquidos:
*Cromatografía de Líquidos:La
cromatografía se utiliza con los fluidos, que pueden ser gases o líquidos, se
empuja a circular la mezcla por un sólido o un líquido que permanece
estacionario (fase estacionaria).
Los distintos componentes de la mezcla
circulan a velocidades diferentes por la fase estacionaria, y por lo tanto unos
componentes están más tiempo retenidos de ella que otros, emergiendo después.
Sirve como método físico de separación.
La fase estacionaria puede ser
típicamente un sólido poroso como la celulosa, o como el gel. Las moléculas de
menor tamaño pueden cruzar todos los poros e invierten más tiempo en el
recorrido mientras que las moléculas mayores de la mezcla no “pierden tiempo”
en los poros, emergiendo más rápidamente.
*Cromatografía Gas sólido: película liquida
con alto punto de ebullición (Silicon o Polietileno) que recubre un sólido
inerte (cromatografía gas líquido), cromatógrafo de gases (CG).Todo compuesto
que pueda ser separado por cromatografía ha de ser volátil y termicamente
estables.































